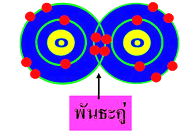
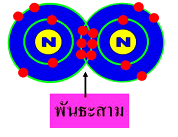
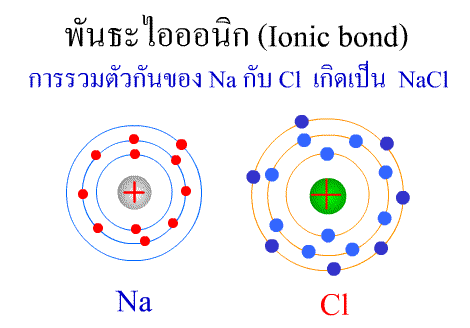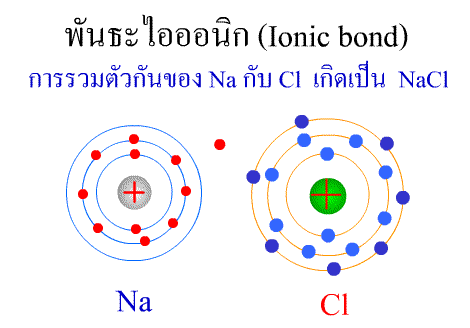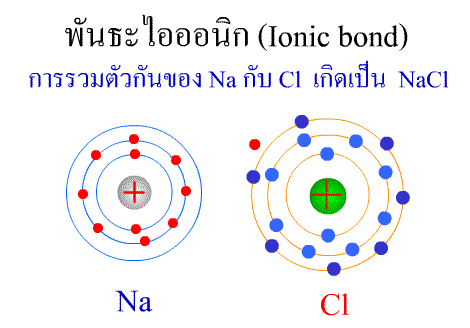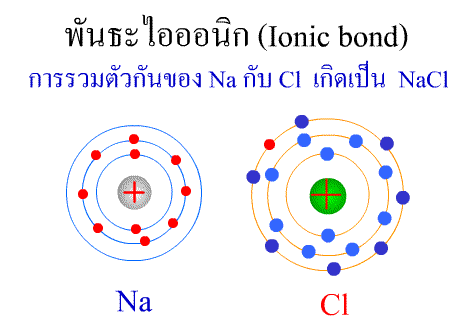
สารประกอบของธาตุทรานซิชัน
1.การเกิดสี1.สีของธาตุทรานซิชันจะเปลี่ยนเมื่อเลขออกซิเดชันเปลี่ยน เช่น
สูตร
|
ชื่อ
|
สี
|
Cr2+
|
โครเมียม(II)ไอออน
|
น้ำเงิน
|
Cr3+
|
โครเมียม(III)ไอออน
|
เขียว
|
CrO42-
|
โครเมตไอออน
|
เหลือง
|
Cr2O72-
|
ไดโครเมตไอออน
|
ส้ม
|
Mn2+
|
แมงกานีส(II)ไอออน
|
ชมพูอ่อน, ไม่มีสี
|
Mn(OH)3*
|
แมงกานีส(III)ไฮดรอกไซด์
|
น้ำตาล
|
MnO2*
|
แมงกานีส(IV)ออกไซด์
|
ดำ
|
MnO42-
|
แมงกาเนตไอออน
|
เขียว
|
MnO4-
|
เปอร์แมงกาเนตไอออน
|
ม่วงแดง
|
2.สีจะเปลี่ยนถ้าสารหรือไอออนต่างชนิดกันมาล้อมรอบ เช่นCuSO4.5H2O สีฟ้า และ Cu(NH3)4SO4 สีคราม
3.สีเปลี่ยนเพราะจำนวนสารที่มาเกาะไม่เท่ากัน เช่น CrO42-สีเหลือง และ Cr2O72-
2.สารประกอบเชิงซ้อนของธาตุทรานซิชัน
สารประกอบของธาตุทรานซิชันชนิดต่างๆ เช่น KMnO4 ประกอบด้วย K+ และ MnO-4 ซึ่ง MnO-4 จัดเป็นไอออนเชิงซ้อน ที่มีธาตุทรานซิชันเป็นอะตอมกลางและยึดเหนี่ยวกับอะตอมหรือไอออนอื่นๆที่มาล้อมรอบด้วยพันธะโคเวเลนต์
สารประกอบที่ประกอบด้วยไอออนเชิงซ้อนจัดเป็นสารประกอบเชิงซ้อน ธาตุทรานซิชันส่วนใหญ่จะเกิดเป็นสารประกอบเชิงซ้อนที่มีสีต่างกัน
ปัจจัยที่มีผลต่อสีของสารประกอบเชิงซ้อนของธาตุทรายซิชัน
- เลขออกซิเดชันของธาตุทรานซิชัน - ชนิดของธาตุทรานซิชัน
- จำนวนโมเลกุลหรือไอออนที่ล้อมรอบธาตุทรานซิชัน
ธาตุกึ่งโลหะ
มีคุณสมบัติดังนี้1.มีค่า IE และ EN ค่อนข้างสูง
2.จุดเดือด จุดหลอมเหลว สูง
3.มีความหนาแน่นสูง
4.สามารถนำไฟฟ้าได้
5.สามารถเกิดสารประกอบได้ ทั้งสารประกอบไอออนนิกและสารประกอบโคเวเลนต์
ธาตุกำมันตรังสี
ธาตุกัมมันตรังสี คือ ธาตุที่มีสมบัติในการแผ่รังสีกัมมันตภาพรังสี คือ ปรากฏการณ์ที่ธาตุแผ่รังสีได้อย่างต่อเนื่อง
การแผ่รังสี เป็นการเปลี่ยนแปลงภายในนิวเคลียสของไอโทปที่ ไม่เสถียร(ไอโซโทปของนิวเคลียสที่มีอัตราส่วนระหว่างจำนวนนิวตรอนต่อจำนวนโปรตอนไม่เหมาะสม) เนื่องจากนิวเคลียสของธาตุกัมมันตรังสีมีพลังงานสูงมากและไม่เสถียร จึงปล่อยพลังงานออกมาในรูปของอนุภาคหรือรังสีบางชนิด แล้วธาตุเหล่านั้นก็จะเปลี่ยนเป็นธาตุใหม่
ชนิดและสมบัติของรังสีบางชนิด
รังสีแอลฟาหรือ อนุภาคแอลฟา
- อนุภาคประกอบด้วย 2 โปรตอน 2 นิวตรอน เหมือนนิวเคลียสของอะตอมฮีเลียม มีเลขมวล 4
- มีประจุไฟฟ้า +2
- มีอำนาจทะลุทะลวงต่ำมาก ไม่สามารถผ่านแผ่นกระดาษหรือโลหะบางๆได้
- เบี่ยงเบนในสนามแม่เหล็ก โดยเบนเข้าหาขั่วลบ
รังสีบีตา หรือ อนุภาคบีตา
- มีสมบัติเหมือนอิเล็กตรอน
- มีประจุไฟฟ้า -1 มีมวลเท่ากับมวลอิเล็กตรอน
- มีอำนาจทะลุทะลางมากกว่า รังสีแอลฟา ถึง 100 เท่า สามารถผ่านโลหะแผ่นบางๆ
- มีความเร็วใกล้เคียงความเร็วแสง
- เบี่ยงเบนในสนามแม่เหล็ก โดยเบนเข้าหาขั่วบวก
รังสีแกมมา
- เป็นคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นสั้นมาก
- ไม่มีประจุไม่มีมวล
- มีอำนาจทะลุทะลวงสูงมาก สามารถผ่านแผ่นคอนกรีตหนาๆได้
ครึ่งชีวิตของธาตุกัมมันตรังสี
ธาตุกัมมันตรังสีแต่ละชนิดจะสลายตัวได้เร็วหรือช้าแตกต่างกัน ปริมาณการสลายตัวของธาตุกัมมันตรังสีจะบอกเป็น ครึ่งชีวิต(ระยะเวลาที่นิวเคลียสของธาตุกัมมันตรังสี สลายตัวจนเหลือครึ่งหนึ่งของปริมาณเดิม) ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป
ประโยชน์ของธาตุกัมมันตรังสี
ด้านธรณีวิทยา
C-14 หาอายุของวัตตุโบราณที่มีคาร์บอนเป็นองค์ประกอบ
ด้านการแพทย์
I-131 ตรวจดูความปกติของต่อมไธรอยด์
I-132 ตรวจดูภาพสมอง
Na-24 ตรวจดูระบบการไหลเวียนของเลือด
Co-60,Ra-226 รักษาโรคมะเร็ง
P-32 รักษาโรคมะเร็งเม็ดเลือดขาว
ด้านการเกษตร
P-32 ตรวจวัดรังสีที่ใบของพืช
ปรับปรุงเมล็ดพันธุ์พืช
Co-60 ทำลายแบคทีเรีย,ถนอมอาการ
ด้านการอุสาหกรรม
รังสีทำให้อัญมณีมีสีสันสวยงามขึ้น
ตรวจหารอยรั่วของท่อส่งน้ำมัน
ด้านพลังงาน
ธาตุกัมมันตรังสีแต่ละชนิดจะสลายตัวได้เร็วหรือช้าแตกต่างกัน ปริมาณการสลายตัวของธาตุกัมมันตรังสีจะบอกเป็น ครึ่งชีวิต(ระยะเวลาที่นิวเคลียสของธาตุกัมมันตรังสี สลายตัวจนเหลือครึ่งหนึ่งของปริมาณเดิม) ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป
ประโยชน์ของธาตุกัมมันตรังสี
ด้านธรณีวิทยา
C-14 หาอายุของวัตตุโบราณที่มีคาร์บอนเป็นองค์ประกอบ
ด้านการแพทย์
I-131 ตรวจดูความปกติของต่อมไธรอยด์
I-132 ตรวจดูภาพสมอง
Na-24 ตรวจดูระบบการไหลเวียนของเลือด
Co-60,Ra-226 รักษาโรคมะเร็ง
P-32 รักษาโรคมะเร็งเม็ดเลือดขาว
ด้านการเกษตร
P-32 ตรวจวัดรังสีที่ใบของพืช
ปรับปรุงเมล็ดพันธุ์พืช
Co-60 ทำลายแบคทีเรีย,ถนอมอาการ
ด้านการอุสาหกรรม
รังสีทำให้อัญมณีมีสีสันสวยงามขึ้น
ตรวจหารอยรั่วของท่อส่งน้ำมัน
ด้านพลังงาน
U-235,U-238,Pu-239 ผลิตไฟฟ้าในโรงไฟฟ้าปรมาณู
โทษของธาตุกัมมันตรังสี
เมื่อร่างกายได้รับรังสีจำนวนมากทำให้โมเลกุลของน้ำ สารอินทรีย์และสารอนินทรีย์ต่างๆ ในร่างกายเสียสมดุล ทำให้เกิดความเสียหายต่อเซลล์ในร่างกาย ไม่สามารถทำงานได้ตามปกติ อาจทำให้เซลล์เกิดการเปลี่ยนแปลงหรือกลายพันธุ์ และรังสีแอลฟาจะทำลายเซลล์เม็ดเลือดแดง
ปฏิกิริยานิวเคลียร์
เป็นการเปลี่ยนแปลง ในนิวเคลียสของธาตุ และมีพลังงานเกี่ยวข้องกับปฏิกิริยาจำนวนมหาศาล
ปฏิกิริยาฟิชชัน
คือ กระบวนการที่นิวเคลียสของธาตุหนักบางชนิดแตกออกเป็นไอโซโทปของธาตุที่เบากว่า ในการเกิดปฏิกิริยาในแต่ละครั้งจะคายพลังงานออกมาจำนวนมาก และได้ไอโซโทปกัมมันตรังสีหลายชนิด รวมถึงได้นิวตรอน ถ้านิวตรอนที่เกิดขึ้นใหม่นี้ชนกับนิวเคลียสอื่นๆ ก็จะทำให้เกิดปฏิกิริยาฟิชชันต่อไปเรื่อยๆเรียกปฏิกิริยานี้ว่า ปฏิกิริยาลูกโซ่
เมื่อร่างกายได้รับรังสีจำนวนมากทำให้โมเลกุลของน้ำ สารอินทรีย์และสารอนินทรีย์ต่างๆ ในร่างกายเสียสมดุล ทำให้เกิดความเสียหายต่อเซลล์ในร่างกาย ไม่สามารถทำงานได้ตามปกติ อาจทำให้เซลล์เกิดการเปลี่ยนแปลงหรือกลายพันธุ์ และรังสีแอลฟาจะทำลายเซลล์เม็ดเลือดแดง
ปฏิกิริยานิวเคลียร์
เป็นการเปลี่ยนแปลง ในนิวเคลียสของธาตุ และมีพลังงานเกี่ยวข้องกับปฏิกิริยาจำนวนมหาศาล
ปฏิกิริยาฟิชชัน
คือ กระบวนการที่นิวเคลียสของธาตุหนักบางชนิดแตกออกเป็นไอโซโทปของธาตุที่เบากว่า ในการเกิดปฏิกิริยาในแต่ละครั้งจะคายพลังงานออกมาจำนวนมาก และได้ไอโซโทปกัมมันตรังสีหลายชนิด รวมถึงได้นิวตรอน ถ้านิวตรอนที่เกิดขึ้นใหม่นี้ชนกับนิวเคลียสอื่นๆ ก็จะทำให้เกิดปฏิกิริยาฟิชชันต่อไปเรื่อยๆเรียกปฏิกิริยานี้ว่า ปฏิกิริยาลูกโซ่
ปฏิกิริยาฟิวชัน
คือ กรณีที่นิวเคลียสของธาตุเบาสองชนิดหลอมรวมกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่าเดิม และให้พลังงานปริมาณมาก การเกิดปฏิกิริยาฟิวชันจะต้องใช้พลังงานเริ่มต้นสูงมาก เพื่อเอาชนะแรงผลักระหว่างนิวเคลียสที่จะเข้ารวมกัน
คือ กรณีที่นิวเคลียสของธาตุเบาสองชนิดหลอมรวมกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่าเดิม และให้พลังงานปริมาณมาก การเกิดปฏิกิริยาฟิวชันจะต้องใช้พลังงานเริ่มต้นสูงมาก เพื่อเอาชนะแรงผลักระหว่างนิวเคลียสที่จะเข้ารวมกัน